Порошок D-маннозы для профилактики рецидивов инфекций мочевыводящих путей у женщин: рандомизированное клиническое исследование
Бояна Кранйчец (Bojana Kranjcec), Дино Папеш (Dino Papeš), Сильвио Альтарац (Silvio Altarac)
© Шпрингер-Ферлаг Берлин Гейдельберг 2013 (Springer-Verlag Berlin Heidelberg 2013)
Б. Кранйчец Отделение медицинской биохимии, Забокская больница общего профиля, г. Забок, Хорватия
Д. Папеш Отделение педиатрической хирургии и урологии, Загребская центральная клиническая больница, г. Загреб, Хорватия
С. Альтарац Отделение хирургии и урологии, Забокская больница общего профиля, 49210 г. Забок, Хорватия
Оригинальная ссылка на полный текст публикации: www.ncbi.nlm.nih.gov/pubmed/23633128
Аннотация:
Цель
Проверить эффективность порошка D-маннозы для предотвращения рецидивов инфекций мочевыводящих путей (ИМП).
Материалы и методы
После первоначальной антибиотикотерапии острого цистита были отобраны и случайным образом разделены на три группы 308 женщин с историей рецидивов ИМП без каких-либо иных значимых сопутствующих патологий. Первая группа (n = 103) получала профилактику в виде 2 г порошка D-маннозы в 200 мл воды ежедневно в течение 6 месяцев, вторая группа (n = 103) получала ежедневно 50 мг нитрофурантоина (фурадонина), а третья группа (n = 102) не получала никакой профилактики.
Результаты
В итоге у 98 пациентов (31,8%) наблюдались рецидивы ИМП: 15 (14,6) в группе D-маннозы, 21 (20,4) — в группе нитрофурантоина и 62 (60,8) — в группе без профилактики, при том что число рецидивов в группе без профилактики оказалось значительно выше по сравнению с активными группами (P <0,001). Пациенты в группе D-маннозы и группе нитрофурантоина показали значительно более низкий риск возникновения рецидива ИМП во время профилактической терапии по сравнению с пациентами группы без профилактики (RR 0,239 и 0,335, P < 0,0001). В активных группах у 17,9% пациентов наблюдались побочные эффекты, но они были умеренными и не требовали прекращения профилактики. Пациенты в группе D-маннозы имели значительно более низкий риск возникновения побочных эффектов по сравнению с пациентами в группе нитрофурантоина (RR 0,276, P < 0,0001), но клиническая значимость данного вывода низка ввиду хорошей переносимости нитрофурантоина.
Заключения
В рамках нашего исследования порошок D-маннозы значительно снизил риск рецидивов ИМП, который не отличался от показателя группы нитрофурантоина. Потребуются дополнительные исследования для подтверждения результатов данного исследования, но первоначально полученные данные показывают, что D-манноза может быть полезной в целях предупреждения ИМП.
Введение
Инфекции мочевыводящих путей (ИМП) встречаются часто, и по оценкам около 11% женщин в возрасте свыше 18 лет ежегодно получают ИМП [1]. Простые изолированные случаи ИМП не создают для пациентов серьезных проблем. С другой стороны, рецидивы ИМП (определяемые как 2 инфекции в течение 6 месяцев или 3 и более инфекций в течение года) представляют собой тяжелое бремя для пациента и приводят к высоким затратам в сфере здравоохранения. Исследование показало, что примерно у 35-53% женщин, проходивших лечение от ИМП, в течение 12 месяцев случались повторные инфекции [2], а общие затраты на лечение ИМП у женщин в Соединенных Штатах, за исключением затрат на амбулаторные назначения, в 2000 году составили приблизительно 2,47 млрд. долларов [3]. Для предотвращения рецидивов ИМП использовались два основных режима применения антибиотиков: долговременная антибиотическая профилактика и посткоитальные антибиотики [4]. В рамках объемного анализа было обнаружено, что долговременная антибиотическая профилактика (в течение 6-12 месяцев) значительно снизила долю женщин с клиническими рецидивами в течение периода профилактики по сравнению с плацебо, однако никаких выводов относительно оптимальной продолжительности, графика и дозировки такой профилактики сделать было нельзя, поэтому в настоящее время нет единого мнения ни относительно того, когда начинать терапию, ни того, как долго она должна продолжаться [5]. Также было показано, что после прекращения профилактики число инфекций возвращается к прежнему уровню с возникновением рецидивов у почти 60% пациентов в течение 3 месяцев [4, 6]. Возможные побочные эффекты (хоть они и редки), затраты и растущая бактериальная стойкость к антибиотикам также являются недостатками долговременной антибиотической профилактики [5, 7, 8], в связи с чем отстаивались альтернативные методы профилактики, такие как клюквенный сок, пробиотики и D-манноза.
D-манноза представляет собой сахар, играющий важную роль в обмене веществ человека, особенно при гликозилировании отдельных белков. Предполагаемый механизм действия состоит в угнетении бактериальной адгезии в отношении уроэпителиальных клеток. Лабораторные эксперименты показали, что D-манноза связывается с фимбриями типа 1 энтеробактерий, блокируя их адгезию к уроэпителиальным клеткам, а в ходе экспериментов на живых животных было подтверждено снижение уровня бактериурии [9-13]. Несмотря на четко установленное антиадгезионное действие D-маннозы и тот факт, что на рынке уже присутствует множество видов порошка D-маннозы для предупреждения ИМП у людей и животных, никаких клинических испытаний для оценки ее эффективности не проводилось. Это привело нас к необходимости осуществить рандомизированное клиническое исследование, чтобы установить влияние регулярного приема порошка D-маннозы на снижение частоты рецидивов ИМП по сравнению со стандартной профилактикой нитрофурантоином и отсутствием профилактического вмешательства.
Пациенты и методы
Проводилось перспективное, рандомизированное контролируемое исследование с целью сравнения эффективности ежедневного приема порошка D-маннозы для предупреждения рецидивных инфекций мочевыводящих путей.
Набор пациентов осуществлялся нами в период с октября 2010 г. по октябрь 2012 г. в Забокской районной больнице общего профиля, а также пяти местных терапевтических пунктах. К участию в исследовании приглашались женщины, страдавшие острым циститом и имевшие историю рецидивного цистита. Все пациенты дали письменное информированное согласие на участие в исследовании. CONSORT-схема исследования приведена на Рис. 1.
Критериями для включения в исследование являлись возраст свыше 18 лет и положительная история рецидивного цистита, определяемая как не менее два случая острого цистита за последние 6 месяцев и/или 3 случая острого цистита за последний год.
Исключались пациенты, находившиеся в состоянии беременности, кормления грудью или предпринимавшие попытки зачать, имевшие симптомы инфекции верхних мочевыводящих путей и симптомы системной воспалительной реакции (температура тела свыше 38°C, число белых кровяных телец свыше 12000), имевшие историю аномалий мочеполового тракта, промежуточного цистита или диабета, а также принимавшие гормональную терапию, контрацептивные средства или ранее проходившие профилактику с применением антибиотиков.
Диагностика ИМП основывалась на наличии в 1 мл гигиенически чистой, полученной естественным путем мочи средней порции 103 или более колоние-образующих единиц (КОЕ), а также, по меньшей мере, двух из перечисленных ниже симптомов со стороны нижних мочевыводящих путей: дизурия, частое мочеиспускание, неотложные позывы, боль в надлобковой области, никтурия и гематурия.
Забор образцов производился из средней порции мочи пациентов, не мочившихся в течение как минимум 3 часов, после промывания генитальной области стерильной водой. Образцы посевов мочи хранились при 4 °C и анализировались в течение 24 часов в районном управлении здравоохранения.
Лечение первоначальной ИМП проводилось препаратом "Ципрофлоксацин" (Ciprofloxacin) по 500 мг два раза в день в течение 1 недели, после чего производился анализ контрольных образцов мочи. Пациенты с менее чем 103 КОЕ/мл в посеве мочи и без симптомов со стороны нижних мочевыводящих путей считались вылеченными и были случайным образом разделены на три группы, каждая из которых должна была в течение 6 месяцев получать определенную профилактику: группа 1 получала по 2 г порошка D-маннозы (U-tractTM, Progressive Laboratories, США), растворенного в 200 мл воды ежедневно вечером (в соответствии с рекомендациями производителя), группа 2 (активная контрольная) получала по 50 мг нитрофурантоина (Ninur, Belupo, Хорватия) ежедневно вечером, и группа 3 (контрольная) не получала ничего.
Каждая женщина при поступлении заполнила опросную форму с указанием демографических данных, истории болезни и состояния питания. Для контроля выполнения условий исследования пациенты самостоятельно отмечали прием профилактических препаратов на отчетном листке.
Если в течение профилактического периода у пациента обнаруживались симптомы, указывающие на ИМП, естественным путем производился забор средней порции гигиенически чистой мочи для посева бактериальной культуры. В качестве критерия повторной инфекции мы использовали значение 103 или более КОЕ/мл. В случаях рецидива профилактика прекращалась, назначалась антибиотикотерапия, и повторного участия в исследовании данные пациенты не принимали. Профилактика была прекращена по истечении 6 месяцев (окончание исследования). Через 6 месяцев с начала профилактики со всеми пациентами связались по телефону с просьбой о контрольном посещении. Основным конечным результатом исследования стало число пациентов в каждой группе без рецидивов ИМП по прошествии 6 месяцев.
Статистический анализ осуществлялся с помощью статистического ПО MedCalc, версия 10.3 (авторские права: MedCalc Software bvba 1993–2010).
Объем выборки рассчитывался, исходя из предположения, что вмешательство снизит рецидивы цистита на 20%: с 30% у пациентов без профилактики до менее 10% у пациентов, получавших профилактическое лечение. Стандартный расчет объема выборки привел к результату 62 пациента в группе (с использованием двухстороннего уровня значимости 5%) для степени >80 %.
Для определения существенности разницы между группами нами использовался однофакторный дисперсионный анализ. Риск ИМП оценивался для каждой группы анализом полной выборки в соответствии с назначением. Время до первого рецидива инфекции было представлено в виде кривой Каплана-Мейера, а разницы между группами оценивались по логарифмическому ранговому критерию. Для учета базовых факторов риска инфекции использовался регрессионный анализ Кокса.
Исследование проводилось в соответствии с рекомендациями по надлежащей клинической практике Международной конференции по гармонизации, Хельсинкской декларацией, а также с соблюдением местных законов и правил. Исследование было утверждено экспертным советом во всех исследовательских центрах.
Результаты
Исследование охватывало всего 308 женщин с острым циститом и положительной историей случаев рецидивного цистита. Группы были схожи по своим базовым характеристикам в отношении риска возникновения инфекции мочевыводящих путей (Таблица 1). Выбывших из исследования не было. Средний возраст пациентов составил 49 лет (диапазон 20-79). Из всего числа 146 пациентов находились в постклимактерическом периоде (47,4%), а средний индекс массы тела составил 28,5 (24,8-33,4). Наиболее часто в фазе острого цистита выделялись бактерии Escherichia coli (у 236 пациентов, 76,6 %), затем Enterococcus faecalis (17, 5,5 %), Klebsiella pneumoniae (12, 3,9 %), Streptococcus agalactiae (8, 2.6 %), Proteus mirabilis (7, 2.3 %) и Citrobacter freundii (4, 1,3 %) (Таблица 2). У 24 пациентов (7,8%) были выделены два микроорганизма. Существенного отличия между группами по выделенным микроорганизмам не было.
Среднее число КОЕ на одну культуру составило 104/мл и не различалось по группам. В течение периода профилактической терапии 98 пациентов (31,8%) имели рецидивы ИМП, при этом среднее время от начала профилактики до появления симптомов составило 30 дней (диапазон 20-41) (Таблица 2). Время от начала профилактики до появления симптомов в различных группах существенно не отличалось. Число случаев рецидивного цистита в группе без профилактики было значительно выше по сравнению с группой D-маннозы и группой нитрофурантоина (P <0,001). Пациенты в группе D-маннозы и группе нитрофурантоина показали значительно более низкий риск возникновения рецидива ИМП во время профилактической терапии по сравнению с пациентами группы без профилактики (RR 0,239, 95 % CI 0,146–0,392, P < 0,0001 и RR 0,335, 95 % CI 0,222–0,506, P < 0,0001, Рис. 2). Это означает абсолютное снижение риска на 45% по сравнению с контрольной группой. Различие между группами D-маннозы и нитрофурантоина оказалось несущественным. После нормализации с учетом базовых факторов риска возникновения ИМП, включающих возраст, историю инфекций мочеполовой системы и частоту половых актов, двумя поясняющими переменными, связанными с предупреждением рецидивов, оказались профилактический прием D-маннозы и нитрофурантоина (P = 0,016, регрессионный анализ Кокса).
Во время профилактической терапии у 37 пациентов из 206 получавших профилактику (17,9%) были отмечены побочные эффекты, но они были умеренными и не требовали прекращения профилактики. Пациенты в группе D-маннозы показали значительно более низкий риск возникновения побочных эффектов во время профилактической терапии по сравнению с пациентами группы нитрофурантоина (RR 0,276, 95 % CI 0,132–0,574, P < 0,0001).
Таблица 1. Характеристики пациентов, принимавших участие в исследовании
|
| Группа D-маннозы (n = 103) | Группа нитрофурантоина (n = 103) | Группа без профилактики (n = 102) | P |
| Средний возраст (IQR) | 49 (38–56) | 48 (29–58) | 52 (38–56) | 0,06 |
| Уровень образования, n (%) |
|
|
| 0,49 |
| Начальная школа | 6 (5,8) | 10 (9,7) | 12 (11,8) |
|
| Средняя школа | 89 (86,4) | 85 (82,5) | 80 (78,4) |
|
| ВУЗ | 8 (7,8) | 8 (7,8) | 10 (9,8) |
|
| Сексуально активны, n (%) | 69 (67,0) | 79 (76,7) | 68 (66,7) | 0,20 |
| Частота половых актов, в среднем за месяц (IQR) | 5 (0–6) | 5 (2–6) | 5 (0–6) | 0,40 |
| Пользуются контрацептивами, n (%) | 42 (40,7) | 45 (43,7) | 39 (38,2) | 0,45 |
| В постклимактерическом периоде, n (%) | 52 (50,5) | 42 (40,8) | 52 (51,0) | 0,25 |
| Средний индекс массы тела, (IQR) | 28,5 (22,5–33,2) | 28,5 (25,8–33,6) | 28,6 (24,8–34,5) | 0,24 |
| Случаи цистита, в среднем за последние 6 месяцев (IQR) | 2 (2–5) | 2 (1–5) | 2 (1–5) | 0,68 |
Таблица 2. Микроорганизм-возбудитель первоначальной ИМП и наблюдения в период профилактики в группе D-маннозы
|
| Группа D-маннозы (n = 103) | Группа нитрофурантоина (n = 103) | Группа без профилактики (n = 102) | P |
| Выделенные бактерии при остром цистите, n (%) |
|
|
| 0,98 |
| E. coli | 81 (78,6) | 78 (75,7) | 77 (75,5) |
|
| Другие | 13 (12,6) | 18 (17,5) | 17 (16,7) |
|
| Два микроорганизма | 9 (8,8) | 7 (6,8) | 8 (7,8) |
|
| Рецидив острого цистита в период профилактики, n (%) | 15 (14,6) | 21 (20,4) | 62 (60,8) | 0,001 |
| Среднее время от начала профилактической терапии до появления симптомов цистита (дней), медиана | 43 (15–50) | 24 (15–36) | 28 (20–42) | 0,12 |
| Осложнения в период профилактики, n (%) | 8 (7,8) | 29 (27,2) |
| 0,001 |
| Диарея | 8 (100) | 10 (34,4) |
|
|
| Тошнота |
| 6 (20,7) |
|
|
| Головная боль |
| 3 (10,3) |
|
|
| Кожные высыпания |
| 1 (3,6) |
|
|
| Вагинальное жжение |
| 9 (31,0) |
|
|
Обсуждение
Цель данного исследования состояла в том, чтобы определить, является ли эффективным порошок D-маннозы против рецидивов ИМП у женщин. D-манноза широко доступна в качестве средства против ИМП, а предполагаемый механизм действия состоит в блокировании бактериальной адгезии к уроэпителиальным клеткам. Это было подтверждено как лабораторными экспериментами, так и в ходе экспериментов над животными, но не было предпринято ни одного клинического исследования для проверки эффективности вещества в клинической практике.
В рамках нашего исследования порошок D-маннозы в течение 6 месяцев показал такую же эффективность в предупреждении ИМП, как и стандартная профилактика нитрофурантоином. Обе группы, получавшие профилактику, имели значительно более низкий уровень рецидивных инфекций по сравнению с группой, не получавшей профилактики.
Общая частота рецидивных ИМП составила около 30%, при этом частота рецидивов у пациентов, не получавших профилактики, (60%) оказалась выше ожидаемой, поскольку в других исследованиях частота рецидивов обычно составляла от 15 до 53% в пределах 6- или 12-месячного периода [2, 14, 15]. Это, вероятно, может быть вызвано несколькими факторами, такими как характеристики населения и методология других опубликованных исследований. В рамках нашего исследования половина участников находились в постклимактерическом возрасте, население привлекалось сельское с низким уровнем образования, а средний индекс массы тела указывает на то, что большинство имело избыточный вес — все эти характеристики предположительно повышают заболеваемость ИМП [2, 16, 17]. Тем не менее, это не влияет на достоверность полученных нами данных, поскольку мы также сделали анализ для прогнозной частоты рецидивов ИМП в группе без профилактики на уровне 30%. В этом случае разница между активными группами и группой без вмешательства по-прежнему оставалась бы существенной (P = 0,01).
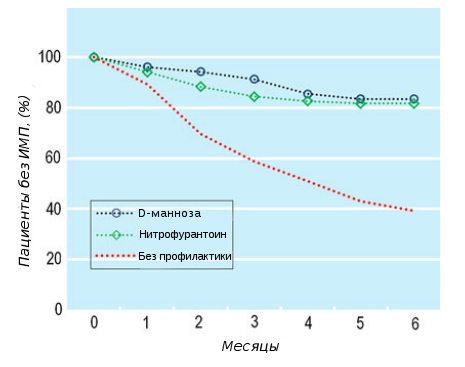
Рис. 2. График Каплана-Мейера, показывающий процентную долю пациентов без рецидивов цистита в течение 6-месячного периода клинического исследования.
Частота рецидивов без профилактики в аналогичных исследованиях существенно отличается, составляя от 15% до 53%, но это может быть вызвано различиями в методологии и характеристиках привлеченного населения. Например, в одном финском исследовании [15] зафиксировано 35% рецидивов через 6 месяцев контрольного наблюдения, однако критерием диагностики рецидива ИМП было наличие в посеве мочи 105 или более КОЕ/мл, в то время как нашим критерием было значение 103 или более КОЕ/мл. Также, в нескольких исследованиях [14, 15] пациенты привлекались на профилактику после первого случая ИМП, в то время как нами привлекались лишь пациенты, имевшие подтвержденную историю рецидивных ИМП в виде не менее 2 случаев за последние 6 месяцев или трех случаев за последние 12 месяцев. Все из упомянутых факторов могут частично служить объяснением более высокого числа рецидивов ИМП в нашем исследовании. Для лечения первичной ИМП нами назначался прием Ципрофлоксацина в течение 7 дней, поскольку мы предпринимали попытку антибактериальной терапии, а такой режим с большой долей вероятности является более эффективным [18].
Побочные эффекты наблюдались чаще у пациентов, принимавших нитрофурантоин, чем у принимавших D-маннозу, но все зафиксированные побочные эффекты были умеренными и не стали причиной для отмены профилактики у пациентов. Клиническая значимость этого вывода низка, так как нитрофурантоин в целом хорошо переносится пациентами с низкой резистентностью E. coli (менее 3%), а во время долговременной профилактики осложнения встречаются редко [19, 20].
Данное исследование имеет несколько недостатков. Один возможный недостаток состоит в том, что оно не было слепым. Мы посчитали, что маскирование в нашем случае не было необходимым, поскольку основное отслеживаемое событие (рецидив ИМП) диагностировалось на основании самоотчета пациентов о возобновившихся симптомах со стороны нижних мочевыводящих путей при подтверждении ИМП положительными результатами посева мочи — объективными данными, сводящими к минимуму потенциальную погрешность. Во-вторых, в силу того, как было спланировано исследование, мы не могли вычислить общее число рецидивов в расчете на пациента, поскольку после антибиотикотерапии рецидивной инфекции данные пациенты нами повторно в исследование не включались.
Результаты нашего исследования показывают, что для определенной отобранной группы D-манноза может быть эффективным профилактическим средством, которое может иметь практическое значение. Однако, для подтверждения и валидации полученных нами результатов, безусловно, потребуются дополнительные исследования, основанные на опыте использования продуктов клюквы для предотвращения ИМП. Множественными лабораторными исследованиями было показано, что продукты клюквы, подобно D-маннозе, угнетают бактериальную адгезию к эроэпителиальным клеткам [21, 22]. Но в клинической практике были получены противоречивые результаты, и полезность продуктов клюквы для предотвращения ИМП по-прежнему не была доказана. В последнем обзоре Кокрановской Базы данных на эту тему было сделано заключение, что продукты клюквы в настоящее время не могут рекомендоваться для предупреждения ИМП [23], хотя имеется множество качественных исследований, четко показавших их эффективность. Возможная причина противоречивых результатов различных исследований состоит в том, что во многих из них использовались различные продукты клюквы без четко определенных действия, дозировки и содержания активного вещества, что является известной проблемой всех лекарственных средств природного происхождения. Также отсутствуют и должны быть предприняты исследования фармакокинетики, которые бы определили точную дозировку и режим приема D-маннозы.
Заключение
В рамках нашего исследования в ходе 6-месячной профилактики была показана эффективность порошка D-маннозы для предупреждения ИМП. Частота рецидивов у пациентов, принимавших нитрофурантоин в качестве стандартной профилактики, не отличалась от тех, кто принимал порошок D-маннозы. Для валидации результатов данного исследования потребуются дополнительные исследования, но первоначальные выводы показывают, что D-манноза может быть полезной для предупреждения ИМП у отдельных пациентов.
Конфликт интересов
Все авторы заявляют об отсутствии у них конфликта интересов.
Источники
1. Foxman B, Brown P (2003) Эпидемиология инфекций мочевыводящих путей: факторы передачи и риска, частота и затраты. Infect Dis Clin North Am 17:227–241
2. Ikäheimo R, Siitonen A, Heiskanen T, Kärkkäinen U, Kuosmanen P, Lipponen P, Mäkelä PH (1996) Повторное возникновение инфекции мочевыводящих путей в контексте первичного обращения: анализ повторного обследования 179 женщин через 1 год. Clin Infect Dis 22:91–99
3. Griebling TL (2005) Проект "Урологические заболевания в Америке": направления использования ресурсов при лечении инфекций мочевыводящих путей у женщин. J Urol 173:1281–1287
4. Nickel JC (2005) Практическое лечение рецидивных инфекций мочевыводящих путей у женщин предклимактерического возраста. Rev Urol 7:11–17
5. Albert X, Huertas I, Pereiró II, Sanfélix J, Gosalbes V, Perrota C (2004) Антибиотики для предотвращения рецидивной инфекции мочевыводящих путей у женщин вне беременности. Cochrane Database Syst Rev 3:CD001209
6. Gupta K, Stamm WE (1999) Патогенез и лечение рецидивных инфекций мочевыводящих путей у женщин. World J Urol 17:415–420
7. Schito GC, Naber KG, Botto H, Palou J, Mazzei T, Gualco L, Marchese A (2009) Исследование ARESC: международный обзор резистентности к антимикробным веществам патогенов, вызывающих неосложненные инфекции мочевыводящих путей. Int J Antimicrob Agents 34:407–413
8. Zhanel GG, Hisanaga TL, Laing NM, DeCorby MR, Nichol KA, Palatnik LP, Johnson J, Noreddin A, Harding GK, Nicolle LE, Hoban DJ (2005) Устойчивость к антибиотикам микроорганизмов, выделяемых у амбулаторных пациентов урологического направления: окончательные результаты Северо-Американского совместного альянса по лечению инфекций мочевыводящих путей (North American urinary tract infection Collaborative Alliance, NAUTICA). Int J Antimicrob Agents 26:380–388
9. Schaeffer AJ, Amundsen SK, Jones JM (1980) Воздействие углеводов на адгезию Escherichia coli к эпителиальным клеткам мочевыводящих путей человека. Infect Immun 30:531–537
10. Schaeffer AJ, Chmiel JS, Duncan JL, Falkowski WS (1984) Чувствительная к маннозе адгезия Escherichia coli к эпителиальным клеткам женщин с рецидивными инфекциями мочевыводящих путей. J Urol 131:906–910
11. Bouckaert J, Berglund J, Schembri M, De Genst E, Cools L, Wuhrer M, Hung CS, Pinkner J, Slättegård R, Zavialov A, Choudhury D, Langermann S, Hultgren SJ, Wyns L, Klemm P, Oscarson S, Knight SD, De Greve H (2005) Исследования связывания рецепторов обнаружили новый класс ингибиторов адгезии Escherichia coli с высокой рецепторосвязывающей активностью. Mol Microbiol 55:441–455
12. Michaels EK, Chmiel JS, Plotkin BJ, Schaeffer AJ (1983) Действие D-маннозы и D-глюкозы на вызванную Escherichia coli бактериурию у крыс. Urol Res 11:97–102
13. Gouin SG, Wellens A, Bouckaert J, Kovensky J (2009) Синтетические мультимерные маннозиды гептила в качестве мощных антиадгезивов уропатогенных Escherichia coli. Chem Med Chem 4:749–755
14. Barbosa-Cesnik C, Brown MB, Buxton M, Zhang L, DeBusscher J, Foxman B (2011) Клюквенный сок неспособен предотвратить рецидивную инфекцию мочевыводящих путей: результаты рандомизированного исследования с контролем по плацебо. Clin Infect Dis 52:23–30
15. Kontiokari T, Sundqvist K, Nuutinen M, Pokka T, Koskela M, Uhari M (2001) Рандомизированное исследование употребления сока клюквы-брусники и напитка на основе молочнокислых бактерий (Lactobacillus GG) для предотвращения инфекций мочевыводящих путей у женщин. BMJ 322:1571
16. Semins MJ, Shore AD, Makary MA, Weiner J, Matlaga BR (2012) Влияние избыточного веса на риск инфекции мочевыводящих путей. Urology 79:266–269
17. Saliba W, Barnett-Griness O, Rennert G (2012) Связь между избыточным весом и инфекциями мочевыводящих путей. Eur J Intern Med 24:127–131
18. Milo G, Katchman EA, Paul M, Christiaens T, Baerheim A, Leibovici L (2005) Продолжительность антибактериального лечения неосложненных инфекций мочевыводящих путей у женщин. Cochrane Database Syst Rev 18:CD004682
19. Schmiemann G, Ga ?gyor I, Hummers-Pradier E, Bleidorn J (2012) Профили устойчивости инфекций мочевыводящих путей в терапевтической практике — неэкспериментальное исследование. BMC Urol 12:33
20. Brumfitt W, Hamilton-Miller JM (1998) Показатели эффективности и безопасности долговременного приема нитрофурантоина при урологических инфекциях на основании 18-летнего опыта. J Antimicrob Chemother 42:363–371
21. Guay DR (2009) Клюква и инфекции мочевыводящих путей. Drugs 69:775–807
22. Gupta K, Chou MY, Howell A, Wobbe C, Grady R, Stapleton AE (2007) Продукты клюквы угнетают адгезию p-фимбриальных бактерий Escherichia coli к основным культивируемым клеткам вагинального эпителия и эпителия мочевого пузыря. J Urol 177:2357–2360
23. Jepson RG, Williams G, Craig JC (2012) Ягоды клюквы для предупреждения инфекций мочевыводящих путей. Cochrane Database Syst Rev 10:CD001321
