Пероральное применение D-маннозы при рецидивирующих инфекциях мочевых путей у женщин: пилотное исследование
D Porru, A Parmigiani, C Tinelli, D Barletta, D Choussos, C Di Franco, V Bobbi, S Bassi, O Miller, B Gardella, RE Nappi, A Spinillo and B Rovereto
Оригинальная ссылка на полный текст публикации: www.moh-it.pure.elsevier.com/en/publications/oral-d-mannose-in-recurrent-urinary-tract-infections-in-women-a-p
Вводная информация: При рецидивирующих инфекциях мочевых путей (ИМП) традиционный профилактический прием антибиотиков не влияет на риск рецидива в долгосрочной перспективе. Цель исследования состояла в том, чтобы оценить эффективность D-маннозы в лечении и профилактике рецидивирующих ИМП.
Методы: В этом рандомизированном перекрестном исследовании пациентки включались в исследование, если у них наблюдались симптомы острой ИМП, а также было 3 или более рецидивов ИМП в течение предшествующих 12 месяцев. Пациентки были рандомизированы на 2 группы: одна группа использовала антибиотикотерапию с применением триметоприма / сульфаметоксазола, другая принимала D-маннозу - по 1 г 3 раза в день, каждые 8 часов в течение 2 недель и затем по 1 г 2 раза в день в течение 22 недель. Они получили другую терапию во второй фазе исследования без дальнейшей антибиотикопрофилактики. Оценивалась длительность безрецидивного периода; а также наличие боли в мочевом пузыре (VASp) и ургентности (VASu).
Результаты: Результаты для количественных переменных были выражены в виде среднего значения и СО, все значения были нормально распределены (по тесту Шапиро-Вилка). Всего в исследование было включено 60 пациенток в возрасте от 22 до 54 лет (в среднем 42 года). Среднее время наступления рецидива ИМП составило 52,7 дня при лечении антибиотиками и 200 дней при пероральном приеме D-маннозы (p <0,0001).
Обсуждение: Средние оценки VASp, VASu и среднее число мочеиспусканий в сутки значительно снизилась. D-манноза оказалась безопасным и эффективным средством лечения рецидивирующих ИМП у взрослых женщин. Важно отметить, что значительной части женщин, получающих антибактериальную терапию, положительной динамики достигнуть не удалось.
Введение:
Рецидивирующая ИМП (rUTI) определяется как 3 эпизода инфекции мочевыводящих путей (ИМП) с положительными бактериологическими анализами мочи за 12 месяцев или 2 эпизода - за последние 6 месяцев.1 Традиционная стратегия лечения включают долгосрочное профилактическое противомикробное лечение низкими дозами или посткоитальный прием антибиотика, но, по всей вероятности, эти стратегия не влияет на риск рецидива в долгосрочной перспективе. Пациенты с частыми ИМП, принимающие профилактические противомикробные средства в течение длительного периода времени, во время профилактики практически не болеют, но после прекращения лечения риск рецидива возвращается к исходным показателям 2,3. Долгосрочный прием антибиотиков, по-видимому, не оказывает положительного влияния на восприимчивость пациента к инфекциям.4
Клеточная стенка бактерий Escherichia coli имеет крошечные пальцевидные выступы, которые содержат на поверхности сложные молекулы, называемые лектинами. Лектины действуют как клеточный клей, который связывает бактерии со стенкой мочевого пузыря, по этой причине они не удаляются при мочеиспускании, прикрепившись к маннозосодержащим рецепторам стенки мочевого пузыря.5 D-манноза (рисунок 1) представляет собой простой сахар, структурно связанный с глюкозой; он содержится в некоторых плодах и также синтезируется в организме человека.
.png)
Рисунок 1. Химическая структура D-глюкозы и D-маннозы.
Мы предполагаем, что D-манноза в моче может связывать и выводить бактерии, такие как E. coli, конкурируя за адгезию E.coli к эпителиальным клеткам мочевого пузыря.6-8
В терапии рецидивирующих ИМП у женщин распространенной практикой является борьба с резистентностью E. coli путем изменения типа антибиотика или увеличения его дозы и продолжительности терапии. Однако, при этом бактерии приобретают все большую устойчивость к антибиотикам широкого спектра действия. Вполне вероятно, что часть старой колонии бактерий выживает в мочевом тракте; некоторые бактерии, вероятно, остаются скрытыми и активируются при благоприятных условиях, поэтому постоянные рецидивы могут и не быть истинными рецидивирующими инфекциями. 9
Целью этого рандомизированного перекрестного исследования было оценить, можно ли использовать пероральную D-маннозу в качестве безопасного и эффективного лечения ИМП, а также в качестве профилактики рецидивов ИМП у взрослых женщин.
Методы
В исследование включались женщины старше 18 лет, имевшие острую симптоматическую ИМП и 3 или более эпизодов ИМП, с подтвержденным бактериологическим анализом мочи, в течение предыдущих 12 месяцев, и которые не принимали противомикробные препараты в течение 4 недель, не были беременны или не планировали беременность. Критериями исключения были: инфекции верхних мочевых путей и/или температура выше 38°C, боль в боку или пояснице, заболевания почек, анатомические аномалии, предшествующая гинекологическая операция, прием иммунодепрессантов или иммунные заболевания (таблица 1). Все пациенты дали свое письменное согласие на проведение исследования. Работа велась в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации. Каждый участник, вступивший в исследование, получал на одно из следующих видов лечения в случайном порядке: (a) 5-дневная антибактериальная терапия триметопримом / сульфаметоксазолом 160 мг / 800 мг 2 раза в день, затем однократная доза перед сном в течение 1 недели каждый месяц в течение следующих 23 недель; (b) пероральный прием D-маннозы по 1 г 3 раза в день, каждые 8 часов в течение 2 недель, а затем 1 г 2раза в день в течение 22 недель. Активность D-маннозы выше при нейтральном рН мочи; поэтому пациентам было поручено измерять рН мочи с помощью тест-полосок и принимать бикарбонат натрия 250 мг или цитрат калия 1 г в качестве подщелачивающего агента при рН мочи < 7.
В каждой группе пациентов было 30 человек: первая группа сначала получала антибиотикотерапию, а вторая – D-маннозу. Точка перекреста группы А и В была на 24 неделе исследования. Затем пациенты группы А переходили в группу В и наоборот. Данные пациентов обеих групп, которые имели симптомы ИМП и возвращались к врачу, по крайней мере, один раз были включены в анализ результатов лечения и побочных эффектов.
Таблица 1. Критерии включения и исключения
| Критерии включения | Критерии исключения |
| Женщина старше 18 лет | вИМП и/или температура выше 380С |
| Симптомы острой ИМП | Боль в боку или пояснице |
| Не менее 3 бактериологически подтвержденных эпизодов ИМП за последние 12 месяцев | Заболевания почек |
| Отсутствие антимикробныой терапии за последние 4 недели | Анатомические аномалии |
| Отсутствие беременности или ее планирования | Предшествующие гинекологические операции |
|
| Иммунные заболевания или прием иммунодепрессантов |
Основные критерии оценки
Бактериурия с симптомами ИМП определялась как значительная, если в моче определялось не менее 104/мл бактерий. Анализ мочи делался каждый раз при возникновении симптомов ИМП или в конце исследования. Частота мочеиспускания в течение 24 часов фиксировалась путем заполнения дневника мочеиспусканий до и в конце лечения в обеих группах. Длительность безрецидивного периода (время повторения рецидива (TTR)) оценивалась и сравнивалась между двумя группами терапии; длительность наблюдения за пациентками составила 12 месяцев.
Первичным результатом исследования была длительность безрецидивного периода ИМП, которая оценивалась и сравнивалась как после антибиотикотерапии, так и после приема D-маннозы. ИМП определяли как острую вспышку симптомов цистита + положительный посев мочи. Затем оценивались результаты по визуальной аналоговой шкале (ВАШ) боли и ургентности, зафиксированные в период эпизодов ИМП.
Статистический анализ
Результаты количественных переменных были выражены в виде среднего значения и СО, поскольку все они были нормально распределены (тест Шапиро-Вилка); t-критерий для парных данных использовался для анализа различий в безрецидивных периодах, ВАШ боли, ВАШ ургентности и количестве мочеиспусканий между терапиями. Анализ данных проводился с использованием статистического пакета STATA (выпуск 11.1, 2010, Stata Corporation, College Station, Texas, USA).
Результаты.
В общей сложности 60 пациенток в возрасте от 22 до 54 лет (в среднем 42 года), которые посетили амбулаторную поликлинику нашего урологического отделения, были включены в исследование. Значительная разница в безрецидивном периоде была обнаружена между пациентками, получавшими антибиотики, и пациентками, получавшими D-маннозу. Результаты анализов мочи пациентов, находящихся на лечении в обеих группах, показаны в таблице 2, а факторы риска для ИМП приведены в таблице 3.
Таблица 2. Результаты через 6, 12 и 24 недели во время лечения. Прием 1 г D-маннозы каждые 8 часов у 60 пациенток. Число пациенток с бактериями в моче через 0, 6, 12 и 24 недели после начала лечения.
| Бактерии в моче | До лечения | Через 6 недель | Через 12 недель | Через 24 недели |
| E. Coli | 40 | 28 | 20 | 10 |
| Klebsiella pneumonia | 10 | 12 | 6 | 2 |
| Proteus | 4 | 4 | 6 | 0 |
| Streptococcus agalactiae | 4 | 2 | 0 | 0 |
| Enterococcus | 2 | 0 | 0 | 0 |
| Кол-во пациентов | 60 | 46 | 32 | 12 |
Таблица 3. Факторы риска ИМП у 60 пациентов.
| Синдром раздраженного кишечника | 5 |
| Запор | 26 |
| ИМП через 24-48 часов после полового акта | 24 |
Через 1 неделю после лечения антибиотиками в моче всех пациентов бактерии отсутствовали, а среднее время повторения безрецидивного периода составило 52,7 дня (СО 11,2; 95% доверительный интервал). После терапии D-маннозой безрецидивный период составил 200 дней (СО 50,7) (Рисунок 2); разница была статистически значимой (p < 0.0001).
Из 60 пациенток 45 (75%) имели 1 рецидив во время 24-недельного курса лечения антибиотиками, 10 из 60 (16,6%) имели 2 рецидива, а 5 из 60 (8,3%) не имели рецидивов. 12 из 60 пациенток (20%) имели бактерии в моче во время лечения D-маннозой до завершения 24-недельного лечения, а 48 (80%) оставались без ИМП. РН мочи находился в пределах 6,5 – 7,5. Средняя оценка боли по ВАШ составляла 4,4 (СО: 1,1) до лечения D-маннозой и 2,2 (СО: 0,5) после курса терапии. Средняя оценка ургентности по ВАШ снижалась с 4,6 (СО: 1.1) до 2,6 (СО: 0.7) до и после лечения (Рисунок 2).
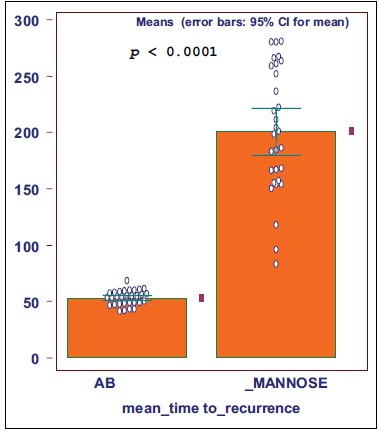
Рисунок 2. Время рецидива у 60 женщин-пациентов с рецидивирующими ИМП с применением антибиотиков: 52,7 дня (SD: 11,2) и при лечении D-маннозой в течение 24 недель: 200 дней (SD: 50,7).
Среднее количество мочеиспусканий составляло 7,1 (СО: 1,7) до применения D-маннозы и 4,7 (SD: 1,0) в конце лечения D-маннозой (Рисунок 3). Все различия были статистически значимыми (р <0,001).
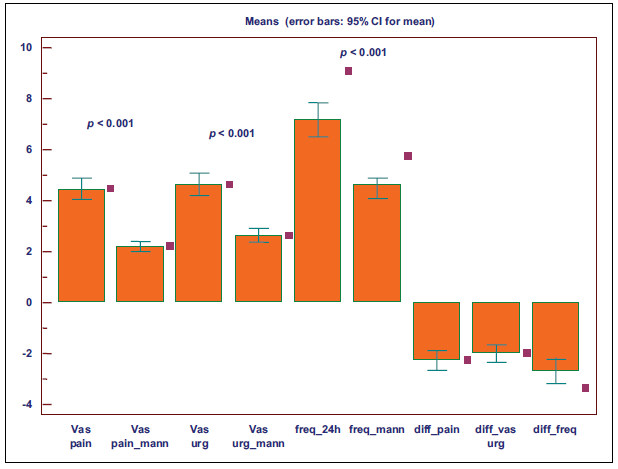
Рисунок 3. ВАШ боли, ВАШ ургентности и 24-часовая частота мочеиспускания при лечении антибиотиками и в течение 24-недельной терапии пероральной D-маннозой. Средняя ВАШ боли от 4,4 (СО: 1,1) до 2,2 (СО: 0,5). Средний бал ургентности по ВАШ от 4,6 (СО: 1,1) до 2,6 (СО: 0,7). Среднее количество мочеиспусканий от 7,1 (СО: 1,7) до 4,7. Все различия были статистически значимыми (р <0,001).
Обсуждение
Из-за необходимости применения альтернативы антибиотикам в терапии рецидивирующей ИМП предлагаются другие схемы лечения или профилактики, такие как введение интравагинально эстриола, применение клюквенного сока per os или вагинальное введение лактобактерий. 10-12
Штаммы E. coli крепятся к в норме стерильному уротелию с использованием пилий типа 1. Было отмечено, что первоначально инвазия на поверхности клеток мочевого пузыря обеспечивает уропатогенную кишечную палочку защитой, в результате которой бактерии могут реплицироваться.14 Впоследствии бактерии, которым удается избежать быстрого удаления из мочевых путей, могут вторгаться в основной эпителий, 15 где они могут создать более стабильный бактериальный резервуар. В этом резервуаре бактерии могут оставаться в течение нескольких недель в состоянии покоя, будучи не обнаруживаемыми иммунной системой и защищёнными от антибиотиков, 16 поскольку эпителий мочевого пузыря для них (иммунитета и антибиотиков) не проницаем. Внутриклеточная уропатогенная E. coli лучше защищена от ряда антибиотиков, включая цефуроксим, гентамицин и триметоприм-сульфаметоксазол. 17-19
Химическая структура D-маннозы заставляет ее прилипать к бактериям E.coli, вероятно, даже более прочно, чем E. coli прикрепляется к клеткам человека. Мы предполагаем, что если в моче присутствует достаточное количество D-маннозы, она может связываться с бактериями и не допускать их прикрепления к слизистой мочевого пузыря.20
В нашем исследовании сравниваются два разных метода лечения для решения проблемы рецидивирующих неосложнённых ИМП у женщин, в течение 6 месяцев. Мы сравнивали результаты терапии антибиотиками и D-маннозы; наш опыт показывает, что D-манноза представляет собой хорошее решение проблемы лечения острых ИМП, а также профилактики рецидивирующих ИМП. Проведение плацебо-контролируемого перекрестного исследования представляется не возможным, поскольку острая ИМП может приводить к тяжелым клиническим симптомам, включая боль, которые могут быть устранены одним из использованных методов лечения. Нет сравнимых исследований с теми же характеристиками, что и D-манноза; при рассмотрении результатов предыдущих исследований 21-23 мы задаемся вопросом, имеют ли долгосрочная антибиотикопрофилактика реальные преимущества по сравнению с длительным приемом D-маннозы, что, возможно, поспособствует дальнейшим репрезентативным исследованиям.
В качестве контрольной группы мы использовали группу ежедневной непрерывной антибиотикопрофилактики в течение 6 месяцев, наиболее популярный метод, 21, предполагая, что антибиотик будет «стерилизовать» мочу путем устранения микроорганизмов; однако его непрерывное и продолжительное использование, вероятно, также снижает нормальную бактериальную флору влагалища и кишечника, что может провоцировать новые рецидивы ИМП у пациентов высокого риска. 24
На основе предыдущего опыта еженедельное периодическое введение триметоприма / сульфаметоксазола было выбрано для контрольной группы 25, а по некоторым данным еженедельная профилактика эффективнее ежемесячной. 26
Манноза участвует в обширной серии метаболических превращений, включается в гликопротеины и гликолипиды или преобразуется во фруктозу, которая затем включается в гликопротеины. Основным источником маннозы является глюкоза. Манноза в виде свободного сахара содержится в персиках, яблоках и апельсинах, но всасывается из желудочно-кишечного тракта крыс только около 12 % скорости всасывания глюкозы.
Наши данные показывают, что D-манноза обеспечивает как профилактический, так и терапевтический эффект, и мы считаем, что ее свойства могут быть значительно улучшены. Мы знаем, что манноза не обладает бактерицидными свойствами, и вполне возможно, что дозировка и продолжительность терапии должны подбираться индивидуально в зависимости от роста бактерий и скорости репликации в мочевом пузыре и мочевом тракте. Было описано, что большая часть поступившей маннозы связывается с бактериями, сконцентрированными в зараженной моче, и избавляет от инфекции 5. Этот механизм относится к большинству случаев рецидивов ИМП.
Очень часто рецидивы ошибочно рассматриваются как реинфекции: вероятно, что клинические результаты по d маннозе получены при ликвидации прогрессирующей бактериальной нагрузки в моче, «живыми», хотя и инактивированными, неподвижными и лишенными патогенного потенциала из-за связанной с ними маннозы. Это основная причина проведения перекрестного исследования с достаточно длительным периодом лечения D-маннозой; для повышения эффективности и получения адекватного периода без инфекции, D-маннозы требуется больше времени, чем для лечения антибиотиками. Дальнейшие исследования должны прояснить положительный эффект снижения частоты рецидивов для микроорганизмов, отличных от E. coli, таких как Klebsiella и Proteus (таблица 2), которые, как известно, не крепятся с помощью пилей к уротелию. О каких-либо серьезных побочных явлениях во время терапии, которые бы ей препятствовали, не сообщалось. Было показано, что D-манноза дозазависимо уменьшает количество бактерий у крыс. Основные микробиологические данные в экспериментах in vitro отсутствует. Однако было обнаружено, что D-манноза значительно снижает количество бактерий в течение 1 дня 23,27,28, и в модели цистита на крысах потенциал конструкции антагонистов ИМП на основе лигандов определяется структурной мимикой природных эпитопов и распространяется на блокирование бактериальной инвазии, внутриклеточного роста и способности к флюсу и рецидиву инфекции.23
Консультации
В нашем исследовании пероральный прием D-маннозы показал себя безопасным и перспективным способом для лечения острых и рецидивирующих ИМП у взрослых женщин, которые существенно осложняют их сексуальную жизнь. Это был первый опыт в клинической практике, предыдущие данные были получены в исследованиях на животных. Статистически значимая разница наблюдалась в отношении доли женщин без рецидива как во время лечения в течение 24 недель, для лечения острых эпизодов, так и в качестве безопасной профилактической терапии рецидивов ИМП, по сравнению с целенаправленной антибиотикотерапией.
Необходимы в будущем научные и клинические исследования на более широких группах населения для установления и подтверждения применения D-маннозы в качестве удобной, безопасной и эффективной терапии.
Конфликт интересов
Не объявлялся
Финансирование
Это исследование не получило специфического гранта от какого-либо финансирующего агентства в публичных, коммерческих или некоммерческих секторах.
Список литературы:
1. Albert X, Huertas I, Pereiro I, et al. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 3: CD001209.
2. Stamm WE, Wagner KF, Amsel R, et al. Antimicrobial prophylaxis of recurrent urinary tract infections: A doubleblind, placebo controlled trial. Ann Intern Med 1980; 92: 770–775.
3. Vosti KL. Recurrent urinary tract infections: prevention by prophylactic antibiotics after sexual intercourse. JAMA 1975; 231: 934–940.
4. Mazzulli T. Resistance trends in urinary tract pathogens and impact on management. J Urol 2002; 168: 1720–1722.
5. Ofek I and Beachey EH. Mannose binding and epithelial cell adherence of Escherichia coli. Infect Immun 1978; 22: 247–254.
6. Schaeffer AJ. Infections of the urinary tract. In: Walsh PC, Retik AB, Vaughan ED, et al. (eds). Campbell’s Urology. Downloaded from uro.sagepub.com by guest on October 13, 2015 Porru et al. 213 8th ed. Philadelphia: WB Saunders Company, 2002. pp.539–544.
7. Anderson G. Intracellular bacterial biofilm-like pods in urinary tract infections. Science 2003; 301: 105–107.
8. Alton G, Kjaergaard S, Etchison JR, et al. Oral ingestion of mannose elevates blood mannose levels: A first step toward a potential therapy for carbohydrate-deficient glycoprotein syndrome type I. Biochem Mol Med 1997; 60: 127–133.
9. Bar-Shavit Z, Goldman R, Ofek I, et al. Mannose-binding activity of Escherichia coli: A determinant of attachment and ingestion of the bacteria by macrophages. Infect Immun 1980; 29: 417–424.
10. Mohsin R and Siddiqui KM. Recurrent urinary tract infections in females. J Pak Med Assoc 2010; 60: 55–59.
11. Raz R and Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. New Engl J Med 1993; 329: 753–755.
12. Avorn J, Monane M, Gurwitz JH, et al. Reduction of bacteriuria and pyuria after ingestion of cranberry juice. JAMA 1994; 271: 751–754.
13. Reid G, Bruce AW and Taylor M. Influence of three-day antimicrobial therapy and lactobacillus vaginal suppositories on recurrence of urinary tract infections. Clin Ther 1992; 14: 11–14.
14. Mulvey MA, Lopez-Boado YS, Wilson CL, et al. Induction and evasion of host defenses by type 1-piliated uropathogenic Escherichia coli. Science 1998; 282: 1494–1497.
15. Mulvey MA, Schilling JD and Hultgren SJ. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infect Immun 2001; 69: 4572– 4579.
16. Mulvey MA, Schilling JD, Martinez JJ, et al. Bad bugs and beleaguered bladders: Interplay between uropathogenic Escherichia coli and innate host defenses. Proc Natl Acad Sci U S A 2000; 97: 8829–8835.
17. Kerrn MB, Struve C, Blom J, et al. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. J Antimicrob Chemother 2005; 55: 383–386.
18. Foxman B, Gillespie B, Koopman J, et al. Risk factors for second urinary tract infection among college women. Am J Epidemiol 2000; 151: 1194–1205.
19. Bouckaert J. Receptor binding studies disclose a novel class of high-affinity inhibitors of the Escherichia coli FimH adhesin. Mol Microbiol 2005; 55: 441–455.
20. Ofek I, Goldhar J, Eshdat Y, et al. The importance of mannose specific adhesins (lectins) in infections caused by Escherichia coli. Scand J Infect Dis Suppl 1982; 33: 61–67.
21. JC Nickel. Practical management of recurrent urinary tract infections in premenopausal women. Rev Urol 2005; 7: PMC1477561.
22. Hvidberg H, Struve C, Krogfelt KA, et al. Development of a long-term ascending urinary tract infection mouse model for antibiotic treatment studies. Antimicrob Agents Chemother 2000; 44: 156–163.
23. Wellens A, Garofalo C, Nguyen H, et al. Intervening with urinary tract infections using anti-adhesives based on the crystal structure of the FimH-oligomannose-3 complex. PLoS One 2008; 3: e2040.
24. Schaeffer AJ and Stamey TA. Studies of introital colonization in women with recurrent urinary infections. IX. The role of antimicrobial therapy. J Urol 1977; 118: 221.
25. Nicolle LE. Prophylaxis recurrent urinary tract infections in women. Infection 1992; 20(Suppl 3): S203–S204.
26. Albert X, Huertas I, Pereiró II, et al. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 4: CD001209.
27. Michaels EK, Chmiel JS, Plotkin BJ, et al. Effect of D-mannose and D-glucose on Escherichia coli bacteriuria in rats. Urol Res 1983; 11: 97–102.
28. Sharon N. Carbohydrates as future anti-adhesion drugs for infectious diseases. Biochim Biophys Acta 2006; 1760: 527–537.
